検査の流れ
QFT検査フロー
Stage 1:採血~血液培養~培養後血漿の回収
Point:厳密な採血後の温度管理
専用採血管での採血量は0.8~1.2mlである。
採血後は緩やかに振盪し、採血管内に貼付のヘパリンと速やかに混合して血液凝固が起きないようにする。
クリーンペンチのある施設はエンドトキシンフリーのヘパリン貼付採血管1本に3.5~4.0ml採血し、採血後16時間以内に無菌的に専用採血管に分注して検査する事も可能。この方法は採血される側のストレスが少なくなり、採血する側の負担も少なくなる。また確実に1mlの血液についての検査が可能になる。
採血量(専用採血管)
- Nil : 1ml
- Antigen : 1ml
- Mitogen : 1ml
遵守事項
搬送温度(21.5±3.5℃)
搬送時の継続的微振動除去
![]()

培養
抗原刺激(37℃,16~24h)
培養開始前には必ず採血管を振盪させて、採血管内の抗原等と血液を良く混和させる。この時激しく振盪すると採血管内の分離剤の影響を受け、結果に影響を及ぼす事もある。採血後は16時間以内に培養器内に設置して抗原刺激を開始する。
※培養時間は、添付文書に規定された時間の範囲で自施設ごとに固定し、条件を一定にしておくと自施設の検査技術を比較し易い。
培養前の確認事項
溶血、乳び、血液量
![]()
培養終了後の保存方法
遠心無では2~27℃で3日間。遠心した場合は、2~8℃で28日間。-20℃(好ましくは-70℃以下)で3カ月保存可能である。
培養終了後遠心
4℃で2,000~3,000RCF,15分遠心し、血漿検体を回収
Stage 2:測定(ELISA法)~データ解析
Point:正確な液調製・反応時間・温度、遮光環境が検査精度を左右する。
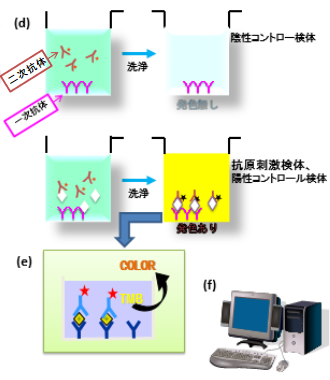
血漿検体と二次抗体を除くELISA試薬は検査開始60分前に22±5℃にしておく。凍結保存した検体は完全に溶解し、撹拌してから使用する。検体は必ず再遠心(1,600RCF, 10分)してから使用する。
一次抗体を固相化したストリップの各ウエルに、HRP標識抗ヒトIFN-γ抗体液(50μl)、 血漿検体(50μl)の順番で添加する。検量線作製のために、血漿検体の代わりにヒトIFN-γ標準液の各濃度(S1~S4)を50μlを添加する。
マイクロプレートシェーカーで1分間混和し、22±5℃で120±5分反応させた後、洗浄液400μℓで最低6回洗浄する。水分を良く切る。
アルミ箔等を用いて遮光環境を作り、酵素基質100μlを添加し、遮光環境中でプレートシェーカーを使用して1分間混合した後、 22±5℃の遮光環境で30分反応させる(発色) 。反応後、酵素気質液を添加した時と同じ順序で反応停止液50μℓを添加し、マイクロプレートリーダーに5分以内にセットする。プレートリーダーは自動的に混合してから測定を開始する。
反応停止後5分以内にマイクロプレートリーダーで各ウエルの吸光度を測定する。
測定波長:450nm, 対照波長:620~650nm。
得られたOD値をQFT専用解析ソフトで国際単位に換算して結果値とする。
※プレートリーダーで測定以降の操作には主観は入らないが、(b)の採血管の振盪、培養温度・時間、(d)のヒトIFN-γ標準液の希釈系列の調製、 HRP標識抗ヒトIFN-γ抗体液や血漿検体の分注量、反応時間、発色反応における時間、遮光環境等を正確に実施することがQFT検査結果を左右する。
T-SPOT.TB検査フロー
1st:採血・PBMC分離・精製・正確に250万個/mlに調整
Point:採血管はエンドトキシンフリー厳密な採血後の温度管理(21.5±3.5℃)

へパリン採血量
0~2才未満:2ml
2~9才未満:4ml
10才以上:5ml
へパリン採血管はエンドトキシンフリーを使用。
採血量は年齢によって異なる。乳幼児の免疫機能は未熟だが、白血球数は多い。このため乳幼児の採血量は2mlで充分である。
採血後すぐに採血管内のへパリンと混合し、凝固しないようにする。
採血後から検査を開始するまでは定温(21.5±3.5℃)で保存する。
この温度はリンパ球の活性を変化させないための温度であるため、血液搬送中も保持しなければならない。
採血後32時間以内であれば検査を行う事が出来る。
全血をRPMI-1640で希釈
採血した血液は、末梢血単核球を分離するためにRPMI-1640メディウムで希釈を行う。分離を正確に行うためにゆっくりと良く混和希釈する。
希釈液の容量は血液量により異なる。
![]()

細胞分離用のFicoll-Paque液を入れた試験管(リューコセップ管)に、
希釈した血液を重層し、規定の重力と時間(1,000×g, 22分)遠心を行う。血液量が少ない場合はリューコセップ管は使用できない。


バフィーコートのみを丁寧に採取し、 RPMI-1640メディウムでゆっくり丁寧に再懸濁する。
600×gで 7分遠心し、上清を捨て RPMI-1640メディウムで再懸濁する。
350×gで7分間遠心して上清を捨て、 700μ?のAIM-Vメディウムで再懸濁し、細胞数を計測後、一検体ごとに正確に 2.5×106/mlに調製する。この時PBMC数が正確に調製されないと正確な検査結果は得られない。続けて第二ステップの培養まで実行する。
2nd: 培養・発色・カウント
Point :培養中のプレート微動は禁忌。スポットの数読は必ず違う人で3回確認
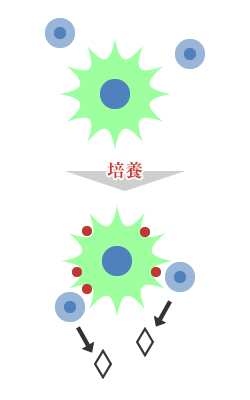
抗原刺激
白血球 : 2.5×105/well
パネルA:ESAT-6
パネルB:CFP-10
陽性コントロール : PHA
陰性コントロール : AIM-V
培養 (37℃、5%CO2) 16h~20h
ストリップの4well夫々に、陰性コントロール(AIM-V), 抗原ESAT-6, CFP-10, 陽性コントロール(PHA) を50μl添加する。
2.5×106/mlに調製した末梢血単核球(PBMC)をストリップ4wellに100μl添加する( 2.5×105/well )。厳密に!
※これ以降揺すったり、ピペットで混ぜたり絶対にしない。
そのままの状態で5%CO2存在下、 37℃の培養器中に静置し、16~20時間培養をおこなう。(培養器の中では、一旦設置したプレートはそのまま培養時間が終了するまで静置しておく。)
※ストリップの各wellの底にはヒトInterferon-γ (IFN‐γ)に対する抗体がコートしてある。被検者が結核に感染していれば、PBMCは抗原特異的にIFN‐γを産生する。この時wellの底にコートしてある抗体と抗原抗体反応を起こして結合するが、少しの振動でスポット形成に影響を及ぼす。

培養終了後洗浄し、二次抗体を添加。4℃で1時間反応。
二次抗体を洗浄後、酵素基質液を添加。室温で厳密に7分発色。蒸留水で洗浄。
乾燥後藍色のスポットを専用スポットカウンターで測定。
培養時間終了後、PBSで4回洗浄する。二次抗体(アルカリフォスファターゼを標識した抗ヒトIFN‐γ抗体)を50μl添加し、4℃で1時間反応させる。
PBSで4回洗浄する。
基質(BCIP, NBT)を50μl添加し、室温で正確に7分反応させた後、蒸留水もしくはmili Q水で洗浄する。
室温もしくは37℃で完全に乾燥させて、専用スポットカウンター、その他顕微鏡で数読する。
※専用スポットカウンターで測定した場合、偽のスポットをカウントしている場合があるので、必ず更に2回目視で確認を行ってから結果を出す。











