QFT検査フロー
Stage 1:採血~血液培養~培養後血漿の回収
Point:厳密な採血後の温度管理
専用採血管での採血量は0.8~1.2mlである。
採血後は緩やかに振盪し、採血管内に貼付のヘパリンと速やかに混合して血液凝固が起きないようにする。
クリーンペンチのある施設はエンドトキシンフリーのヘパリン貼付採血管1本に3.5~4.0ml採血し、採血後16時間以内に無菌的に専用採血管に分注して検査する事も可能。この方法は採血される側のストレスが少なくなり、採血する側の負担も少なくなる。また確実に1mlの血液についての検査が可能になる。
採血量(専用採血管)
- Nil : 1ml
- Antigen : 1ml
- Mitogen : 1ml
遵守事項
搬送温度(21.5±3.5℃)
搬送時の継続的微振動除去
![]()

培養
抗原刺激(37℃,16~24h)
培養開始前には必ず採血管を振盪させて、採血管内の抗原等と血液を良く混和させる。この時激しく振盪すると採血管内の分離剤の影響を受け、結果に影響を及ぼす事もある。採血後は16時間以内に培養器内に設置して抗原刺激を開始する。
※培養時間は、添付文書に規定された時間の範囲で自施設ごとに固定し、条件を一定にしておくと自施設の検査技術を比較し易い。
培養前の確認事項
溶血、乳び、血液量
![]()
培養終了後の保存方法
遠心無では2~27℃で3日間。遠心した場合は、2~8℃で28日間。-20℃(好ましくは-70℃以下)で3カ月保存可能である。
培養終了後遠心
4℃で2,000~3,000RCF,15分遠心し、血漿検体を回収
Stage 2:測定(ELISA法)~データ解析
Point:正確な液調製・反応時間・温度、遮光環境が検査精度を左右する。
血漿検体と二次抗体を除くELISA試薬は検査開始60分前に22±5℃にしておく。凍結保存した検体は完全に溶解し、撹拌してから使用する。検体は必ず再遠心(1,600RCF, 10分)してから使用する。
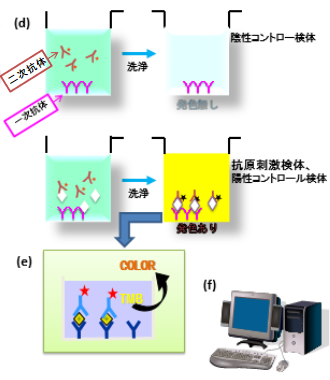
一次抗体を固相化したストリップの各ウエルに、HRP標識抗ヒトIFN-γ抗体液(50μl)、 血漿検体(50μl)の順番で添加する。検量線作製のために、血漿検体の代わりにヒトIFN-γ標準液の各濃度(S1~S4)を50μlを添加する。
マイクロプレートシェーカーで1分間混和し、22±5℃で120±5分反応させた後、洗浄液400μℓで最低6回洗浄する。水分を良く切る。
アルミ箔等を用いて遮光環境を作り、酵素基質100μlを添加し、遮光環境中でプレートシェーカーを使用して1分間混合した後、 22±5℃の遮光環境で30分反応させる(発色) 。反応後、酵素気質液を添加した時と同じ順序で反応停止液50μℓを添加し、マイクロプレートリーダーに5分以内にセットする。プレートリーダーは自動的に混合してから測定を開始する。
反応停止後5分以内にマイクロプレートリーダーで各ウエルの吸光度を測定する。
測定波長:450nm, 対照波長:620~650nm。
得られたOD値をQFT専用解析ソフトで国際単位に換算して結果値とする。
※プレートリーダーで測定以降の操作には主観は入らないが、(b)の採血管の振盪、培養温度・時間、(d)のヒトIFN-γ標準液の希釈系列の調製、 HRP標識抗ヒトIFN-γ抗体液や血漿検体の分注量、反応時間、発色反応における時間、遮光環境等を正確に実施することがQFT検査結果を左右する。











